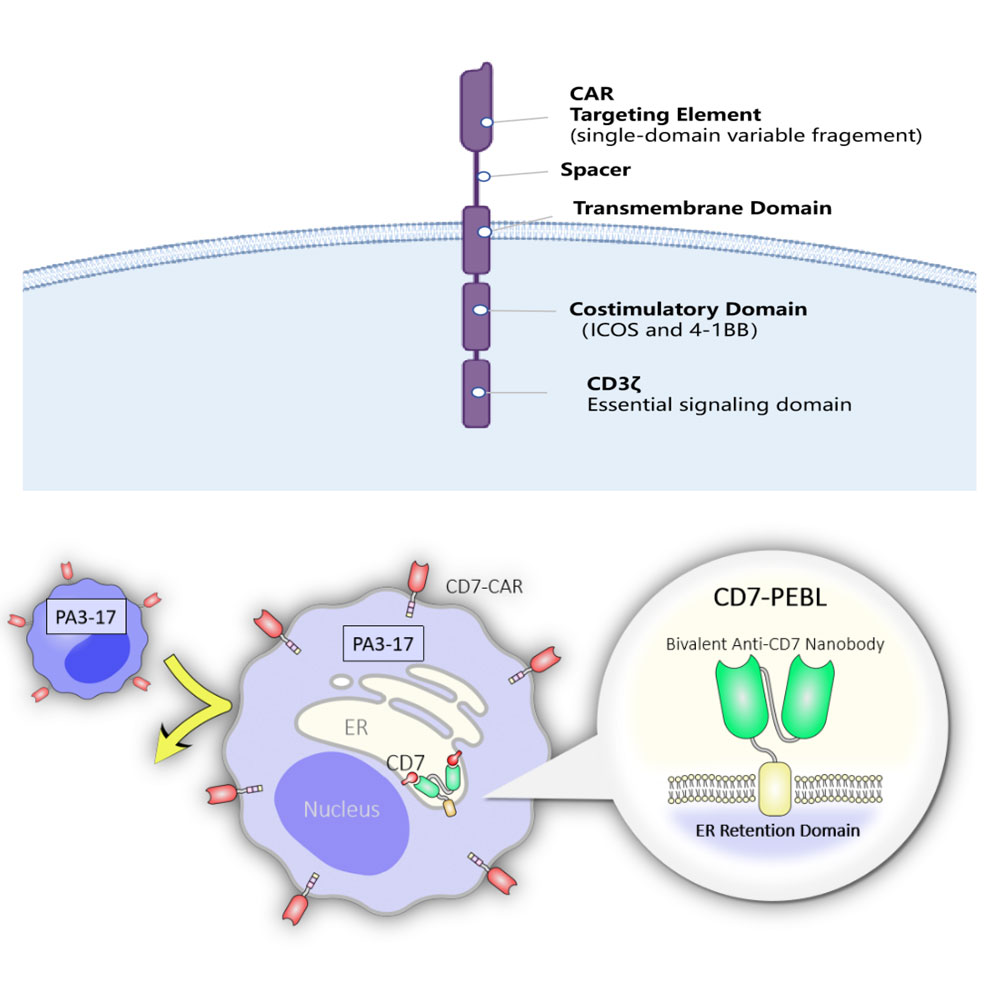
CD7-CAR-T平台
由于正常T细胞也会表达CD7分子,为了解决CD7-CAR-T制备过程中出现的自杀现象,首创性利用CD7纳米抗体将其和内质网滞留序列进行重组表达,将T细胞的 CD7抗原滞留于内质网及高尔基体中,营造T细胞表面CD7阴性状态,从而避免 CAR-T细胞之间的“自相残杀”,成功制备CD7-CAR-T细胞。
CD7-CAR-T的工作原理主要是:通过同时对T细胞转染CD7-CAR慢病毒和CD7膜阻断慢病毒,构建膜表面不表达CD7分子的CD7-CAR-T细胞,避免CD7-CAR-T细胞之间的“自相残杀”,同时达到通过CD7-CAR分子对CD7阳性的T细胞肿瘤进行特异性识别和杀伤。
亮点:
全球领先/稀缺的治疗 T 细胞恶性肿瘤的CAR-T产品
不能被in vivo CAR-T颠覆的ex vivo CAR-T产品