公司新闻
Company News
新闻中心 | 公司新闻 7688次阅读 2022-07-05 08:57
据CDE官网显示,博生吉医药科技(苏州)有限公司(以下简称“博生吉”)自主研发的B7-H3靶向的嵌合抗原受体T细胞注射液(TAA06注射液),已于2022年7月4日获国家药品监督管理局药品审评中心(CDE)的临床试验默示许可,该产品适应症为复发/难治神经母细胞瘤。
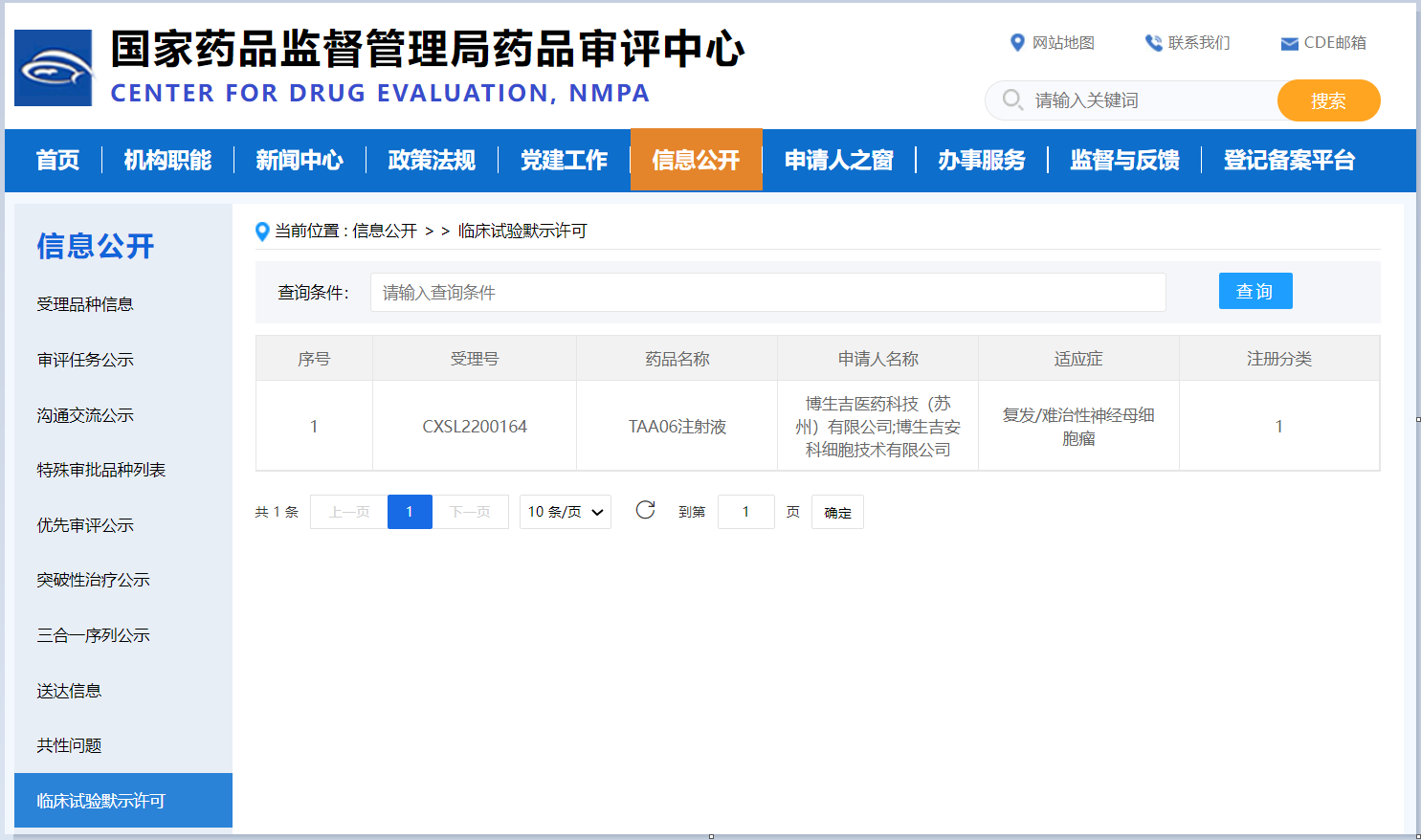
TAA06注射液是博生吉首款用于治疗实体瘤的CAR-T产品,其前期体内外药效学研究和安全性评价均取得了优异的数据。该产品于今年3月先后获得了美国食品药品监督管理局(FDA)孤儿药认定和FDA罕见病认定,并于今年4月8日,IND申请获得CDE正式受理,成为了全球首个获得药监部门受理的B7-H3靶向的CAR-T细胞产品。因此,本次IND获批意味着国际首款靶向B7-H3的CAR-T产品即将进入注册临床阶段,同时也是博生吉在创新型CAR-T细胞药物研发道路上取得的又一具有里程碑意义的进展。
关于神经母细胞瘤
神经母细胞瘤(neoblastoma,NB)是起源于原始交感神经节细胞的神经母细胞性肿瘤。NB是一种几乎仅发生于儿童的常见的颅外实体瘤,发病率位于儿童常发肿瘤第3位,仅次于白血病和脑瘤。NB发病率与年龄相关,临床诊断时平均年龄为17.3个月,40%患儿在1岁之前确诊。30%的NB肿瘤发生在肾上腺髓质内,约60%发生于腹部椎旁神经节,其余发生部位为胸部、头部、颈部以及骨盆的交感神经节等。NB具有异质性,生存率方面表现为85%~90%的低、中度危险患儿可以治愈,而高危NB患儿生存率不足50%。高危的NB患儿经过多次强化治疗后仍难治愈,超过50%的患儿复发,5年生存率约40%~50%。因此,针对高危NB新的治疗方法亟待开发。
关于TAA06注射液
B7-H3(又称CD276)是一种I型跨膜蛋白,属于B7免疫共刺激和共抑制家族,在正常人体组织中表达水平较低,但在人恶性肿瘤如胰腺癌、前列腺癌、卵巢癌、肺癌、透明细胞肾癌、骨肉瘤、尤文肉瘤、神经脑胶质瘤等实体肿瘤中异常高表达。除了成人实体瘤,B7-H3在绝大多数类型的儿童实体瘤(包括:神经母细胞瘤、尤文肉瘤、横纹肌肉瘤、肝母细胞瘤、肾母细胞瘤、中枢神经系统肿瘤等)中也是高表达,这表明TAA06注射液是治疗儿童实体瘤极具潜力的产品。
博生吉TAA06注射液技术优势显著。针对实体肿瘤复杂的免疫微环境,博生吉在靶点选择、CAR结构优化、工艺开发、以及临床方案上,进行了系统性的创新和优化。在前期动物模型中,TAA06注射液展现出单次静脉给药就完全清除全部肿瘤的杰出疗效,是一款极具潜力的实体瘤CAR-T产品。
关于博生吉
成为创新细胞药物研发的领跑者是博生吉的愿景,围绕临床未满足需求、开发患者真正需要的创新药物是博生吉的使命。博生吉是一家以突破性肿瘤细胞免疫治疗技术与细胞药物产品研发为主要发展目标的国家级高新技术企业。公司专注于开发具有国际领先水平的突破性First-in-class和Best-in-class CAR-T细胞药物,以造福肿瘤病患。
公司自主研发的自体CD7-CAR-T细胞注射液,用于治疗难治复发T细胞和NK细胞恶性肿瘤,临床价值重大。该产品已于2021年8月获批中国注册临床,2021年11月获得美国FDA孤儿药认定。靶向B7-H3的嵌合抗原受体(CAR)-T细胞注射液(研发代号:TAA06注射液)于2022年3月先后获得了美国食品药品监督管理局(FDA)孤儿药认定和FDA罕见病认定,并于2022年7月4日获批中国注册临床。
2021年上半年博生吉完成了由元生创投领投,普恩国新股权投资和仙瞳资本跟投的A轮融资;2022年1月又完成了由中金启德和华泰紫金共同领投、磐毅资本和华桐资本共同跟投的B轮融资。公司建成了~1万平米符合GMP规范的全自动CAR-T细胞生产基地,为CAR-T细胞的商业化奠定了坚实基础。